学术论文│硬脑膜/颅缝间充质干细胞对颅骨发育的影响

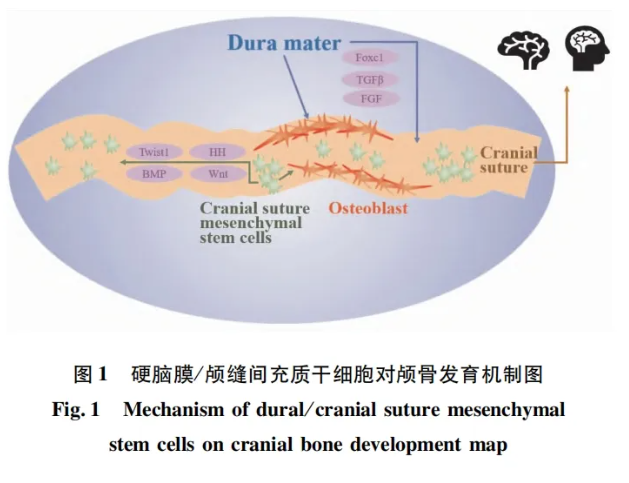
颅缝是颅骨发育的生长中心[1] ,颅缝异常会导致颅骨发育异常,严重时会危及生命。引起颅缝异常的原因众多,如基因突变、硬脑膜发育不良、颅缝间充质干细胞缺失等[2-4]。研究表明,颅缝作为颅骨和大脑之间的调节者,通过释放可溶性因子和调节相关细胞活动发挥作用[5],颅缝间充质是对颅缝发育、颅骨生长和损伤修复至关重要的颅缝间充质干细胞的生态位[6-7],颅缝间充质干细胞过早消融会导致颅缝早闭[3],其在颅缝的开放和闭合过程中发挥重要作用[8]。硬脑膜是脑膜的最外层,是大脑和颅骨之间信号交流的沟通者[9]。在不同的动物模型和体外实验中发现硬脑膜对颅骨正常发育至关重要[10-13],硬脑膜缺失会出现颅骨畸形[4],硬脑膜调节颅缝的开闭状态[14-15]、细胞分化[16-17]等过程。现对颅缝、硬脑膜及颅缝间充质干细胞三者分别发挥作用的机制进行总结(图1),有望为颅缝早闭、颅骨缺损修复等颅脑疾病提供临床依据或新的治疗手段。
1 颅缝及硬脑膜的起源及解剖学关系
颅骨由额骨、顶骨及枕骨等组成,起源于神经嵴和中胚层,其中只有额骨为双重起源,剩余骨均由中胚层衍生而来[18]。颅缝是相邻颅骨之间的纤维关节连接,它们不仅将不同胚胎来源的骨骼分开,而且它们本身是不同的来源。例如,源自神经嵴的颅缝包括额间缝和矢状缝,而冠状缝源自中胚层,人字缝的发育起源仍然未知。胚胎起源的差异可能导致不同颅缝间充质干细胞的不同功能[7, 18]。
硬脑膜在胚胎期第17.5天由神经嵴衍生细胞形成[5,9],神经嵴细胞是一种干细胞,可以产生多种细胞类型和结构[19]。硬脑膜是位于颅骨下方一个致密的双层结缔组织,外层是位于颅骨内表面的骨膜,内层覆盖神经组织和蛛网膜下腔[20-22]。硬脑膜与颅缝间充质、成骨前沿、骨膜共同构成了颅缝复合体[23]。
2 颅缝间充质干细胞及其生理意义
研究[7,24-25]表明颅骨区域的主要间充质干细胞群位于颅骨的颅缝间充质内,称为颅缝间充质干细胞。目前,已有四种细胞被证实为颅缝间充质干细胞,包括Gli1+细胞、Axin2+细胞、Prrx1+细胞和Ctsk+细胞[7]。颅缝不仅是颅骨生长发育的关键部位,也是调节颅骨生长发育的干细胞的生态位。间充质干细胞几乎在所有被研究的组织中都有分布[26],它能够被诱导分化为多种细胞,如成骨细胞、软骨细胞和脂肪细胞,因此是骨组织工程中一种有潜力的细胞[27]。
Axin2+细胞的干细胞特征表现为克隆能力,在研究人员所监测1年中,单细胞水平上检测到克隆扩增的Axin2+细胞。Gli1+细胞也具有相同能力,此外,传代培养后,发现单个Gli1+细胞能够分化为骨、软骨和脂肪,表明它具有多向分化的能力[1, 3]。 以上结果表明它们是颅缝间充质中能够发挥作用的干细胞。
3 硬脑膜对颅骨成骨分化的影响
3. 1 硬脑膜参与调控颅缝状态
硬脑膜是再骨化的充分必要条件,在维持颅缝开放与闭合中起关键作用[9]。Yuetal[28]发现在硬脑膜与颅骨之间放置了10nm孔的Parafilm膜,6周后发现颅缝几乎完全闭合,而未放置组颅缝则保持开放状态,表明硬脑膜有助于维持颅缝开放状态。制作大鼠颅缝旋转模型,在不破坏硬脑膜的情况下,将颅骨瓣分离后旋转180°,原本开放的颅缝提前闭合[29]。
硬脑膜可以直接控制骨细胞的分化[30]。在用已闭合颅缝下方的硬脑膜和开放颅缝下方的硬脑膜分别与成骨细胞共培养,发现二者均可诱导成骨细胞的分化,只是已闭合颅缝下方硬脑膜组的成骨相关因子碱性磷酸酶、骨钙素的含量更高,成骨细胞增殖速度更快[31-32],而颅缝内的成骨分化由诱导与抑制信号的平衡控制[33],因此可能是硬脑膜向颅缝传递了成骨信号,促进成骨细胞成骨,进而影响颅缝状态。此外,硬脑膜等与颅缝相邻的结构为颅缝间充质干细胞发挥作用提供适宜的微环境[28],而颅缝间充质干细胞已被证实在颅缝再生中发挥重要作用[6]。
3. 2 硬脑膜中相关因子对颅骨成骨的影响
硬脑膜中Foxc1、成纤维细胞生长因子(fibroblast growth factor, FGF)、转化生长因子β(transforming growth factor-β, TGF-β)等与颅骨相互作用,影响颅骨的生长发育[9,34-35]。Foxc1在硬脑膜中表达,通过脑膜和颅骨之间的相互作用间接调节颅骨的早期生长[9], Foxc1纯合突变体(Foxc1ch/ch) 表现为脑积水, 其硬脑膜和蛛网膜均未在颅骨顶端形成,颅骨顶端出现严重的骨缺损[10],这种现象证实了硬脑膜对颅骨早期发育的重要性。TGFβ信号转导是脑膜正常发育所必需的,为硬脑膜在维持颅缝稳态中发挥指导作用[34-35], TGFβ受体2( transforming growth fac-tor beta receptor 2 , Tgfbr2)从早期开始就在脑膜间充质中表达,Tgfbr2功能丧失可导致顶骨缺损[9]、颅骨小及下颌骨生长受限[36]。已知硬脑膜分泌的FGF对上覆颅骨发挥作用[37], 已闭合的颅缝复合体中 FGF2蛋白水平比开放状态中高[38], 则表明FGF2影响颅缝状态,进而影响颅骨生长发育。硬脑膜细胞中成纤维细胞生长因子受体2(fibroblast growth factor receptor 2 , FGFR2) 突变可促进成骨细胞的增殖和分化,并可能通过影响Hippo/YAP-PI3K-AKT增殖信号通路来影响颅缝早闭[15]。以上研究结果表明硬脑膜具有分泌各种因子调控颅缝状态、诱导成骨细胞增殖分化以及直接影响颅骨生长发育等功能。
4 颅缝间充质干细胞对颅骨成骨分化的影响
4. 1 颅缝间充质干细胞对颅缝状态的调控
颅缝间充质干细胞在颅骨发育、缺损修复和再生中发挥重要作用。研究表明,颅缝间充质干细胞过早丢失会导致颅缝早闭[7 ,28,39]。他莫昔芬诱导Gli1+细胞消融后1个月,冠状缝和额前上颌缝闭合,诱导2个月后,所有颅缝均闭合[3]。Axin2 在颅缝的成骨前沿和骨膜中表达,在额中缝开始其正常的闭合过程之前,其表达逐渐减弱[40], 通过Wnt-Axin调节网络[40]、与Smad2/3结合以刺激TGFβ信号传导[41]等,这可能是颅缝在出生后逐渐闭合的分子机制,并且Axin2失活也会导致颅缝早闭[42]。应用颅缝间充质干细胞与生物可降解支架——改性甲基丙烯酸明胶相结合后置于原颅缝处可以逆转神经认知异常,并有助于颅缝再生[28]。因此,颅缝间充质干细胞可能是颅缝早闭的一种有前景的治疗方法。
颅缝间充质干细胞的机械敏感性影响颅缝状态。研究者利用弹簧扩张矢状缝,在1、3、7、14、21、 28d后的μCT图像和组织学染色结果显示从负荷 后前3d,颅缝明显扩张,此时的Gli1+细胞快速增殖,第3天后骨边缘出现小突起并进一步延伸,在1个月内颅缝恢复到正常宽度,甚至有小部分区域闭合,这是Gli1+细胞分化为成骨细胞和骨细胞的结果[43]。
4. 2 影响颅缝间充质干细胞成骨过程的分子机制
在颅缝间充质干细胞成骨的过程中存在多种信号通路,各种信号通路之间互相联系,建立起信号网络 发挥作用。
Twist1转录因子是公认的间充质细胞分化抑制剂[44],抑制成骨细胞分化,是骨形成和骨发育过程中影响间充质细胞增殖和分化的关键调节因子[45]。Twist1在间充质干细胞中表达,包括颅缝间充质干细胞[46],其失活可促进颅缝间充质干细胞向成骨分化,导致颅缝早闭[47],例如,Saethre-Chotzen综合征,它表现为复杂的颅缝闭合,最明显的是冠状缝、后额缝和人字缝[48]。Zhao et al[3]检测Twist1+/-小鼠在颅缝闭合前后Gli1 +细胞的表达,结果显示颅缝闭合前Gli1+细胞表达与对照组无明显差异,而颅缝闭合后Gli1+细胞表达显著减少,证明Gli1+细胞增殖分化为成骨细胞,促进新骨形成使得颅缝闭合,以上结果表明,Twist1可以通过调控间充质干细胞来影响颅骨生长发育和损伤修复。此外,Twist1是颅骨成骨细胞分化中转导Wnt信号传导所必需的[49], Twist1在间充质干细胞成骨细胞分化中与FGF和 骨形态发生蛋白(bone morphogenetic protein, BMP) 信号传导相互作用[50]。
Wnt信号促进颅缝间充质干细胞的成骨分化,导致颅缝早闭。应用Wnt激活剂后,颅缝间充质干细胞中Runx2和骨桥蛋白(osteopontin , OPN)表达水平显著增加,表明其向成骨细胞分化作用增强[28]。 从机制上分析表明,Wnt信号通路通过影响 FGF和BMP信号通路的平衡影响颅骨发育过程中颅缝间充质干细胞的命运[7]。
Hedgehog(HH)信号分子通过平衡间充质干细胞与其他邻近细胞(如破骨细胞)的相互作用来调节骨稳态[51-52]。近年来,利用多种基因工程小鼠及体外实验显示Indianhedgehog治疗显著上调颅缝间充质内的主要间充质干细胞——Gli1+细胞[51]的活性并增强成骨分化,而HH抑制剂治疗显著下调Gli1+细胞活性并抑制成骨分化,表明Indianhedge-hog在诱导Gli1+细胞的成骨谱系中起着关键作用[3,7]。HH诱导的成骨需要BMP信号介导来平衡间充质干细胞成骨与破骨细胞破骨,并且它们共同促进碱性磷酸酶的表达[52-53]。
BMP信号通路已被证明是颅面发育模式的重要调节因子,影响颅缝间充质干细胞的成骨潜力、骨化和稳态[54],是工程骨再生中最成熟和最有效的生长因子[55]。BMP信号通路通过BMP配体与BMP受体I型和II型的结合而转导,进一步激活细胞内Smads蛋白,Smads蛋白磷酸化可以与co-Smad4结合成复合物,该复合物在细胞核中促进骨相关基因表达[54]。Gli1+细胞产生的骨祖细胞在颅缝内显示出活跃的BMP信号传导活性。组织学分析证实,Gli1+细胞中BMP受体1A型缺失导致矢状缝、冠状缝等多条颅缝变窄,Gli1+细胞增殖和成骨分化活性增强[52]。有证据证明BMP受体1A型在颅面发育和颅缝早闭中保持颅缝间充质干细胞特性,BMP受体1A型能够影响颅缝间充质干细胞产生异位骨组织,是小鼠和人颅缝间充质干细胞的表面标志物[7]。
5 展望
颅骨的生长发育及正常形态的形成对人的健康至关重要,硬脑膜和颅缝间充质干细胞在其中发挥重要作用。本文就硬脑膜、颅缝及颅缝间充质干细胞对颅骨发育的相关机制进行综述,硬脑膜和颅缝间充质干细胞影响颅缝的开放闭合状态,硬脑膜分泌因子直接或间接影响颅骨发育,Twist1、Wnt、HH等信号形成信号网络调控颅缝间充质干细胞的成骨分化。硬脑膜和颅缝间充质干细胞在协调成骨细胞分化、颅骨生长过程中起关键作用,可能还存在其他机制影响该过程,仍需要进一步探究。
硬脑膜提供各种因子参与颅骨形成,调控颅缝状态[37],也有各种信号通路介导颅缝间充质干细胞向成骨细胞分化,从而影响颅缝的开放与闭合,但是这种机制是否是硬脑膜发出的信号,类似的研究很少,阐明硬脑膜和颅缝间充质干细胞之间的相互作用有利于更深刻地理解其中的作用机制,更好地进行临床转化,是下一步研究的主要方向。颅缝间充质干细胞参与的颅缝再生需要与下面的硬脑膜进行物理接触[56],研究[57]表明,硬脑膜分泌的外泌体可以促进成骨细胞增殖、迁移和分化,并减少细胞凋亡,通过骨细胞中的ALP、OCN和OPN等成骨标志物表达变化表明其在颅骨成骨中发挥作用。
颅缝过早闭合会导致颅内压升高,进而引起视力损害、耳聋、癫痫发作和认知障碍等多种并发症, 通常采用手术治疗,包括切除受影响的颅缝并进行颅骨重建。然而,这些手术对小儿患者具有挑战性,而且仅移除已闭合的颅缝往往会导致颅缝再次闭合,需要二次手术[24,58],颅缝的融合不仅影响颅骨的形态,还会导致生长停滞[3],因此治疗颅缝早闭是临床急需攻克的难题。利用干细胞支架能使颅缝早闭小鼠颅缝再生,再生的颅缝恢复了正常的颅缝基因表达谱[28],这种治疗方式降低了颅内压,纠正了颅骨畸形,改善了神经认知功能。目前用于研究的间充质干细胞很多,包括骨髓间充质干细胞、脂肪间充质干细胞、脐带间充质干细胞及颅缝间充质干细胞等[26]。间充质干细胞具有自我更新、克隆扩增和多向分化的能力,是治疗各种疾病的细胞疗法中有潜力的细胞[59],其中骨髓间充质干细胞已被证明是细胞疗法的合格选择[44]。颅缝间充质干细胞在生长发育过程中能通过膜内成骨形成颅骨[60],其中Gli1+细胞及其衍生物可在硬脑膜中检测到[23]。因此,研究硬脑膜与颅缝间充质干细胞的关系将会是具有前景的研究热点,希望在不久的将来,颅缝间充质干细胞疗法可以成为治疗颅骨缺损和修复畸形的可靠方案,让更多颅脑疾病患者得到更好的治疗。
参考文献
[1] Maruyama T , Jeong J , Sheu T J , et al. Stem cells of the suture mesenchyme in craniofacial bone development , repair and regener- ation [J] . Nat Commun , 2016 , 7 : 10526 . doi : 10 . 1038/ncom- ms10526 .
[2] Yapijakis C , Pachis N , Sotiriadou T , et al. Molecular mecha- nisms involved in craniosynostosis [ J] . In Vivo , 2023 , 37 (1): 36 - 46 . doi : 10 . 21873/invivo. 13052 .
[3] Zhao H , Feng J F , Ho T V , et al. The suture provides a niche for mesenchymal stem cells of craniofacial bones [J] . Nat Cell Biol , 2015 , 17(4): 386 - 96 . doi : 10 . 1038/ncb3139 .
[4] Tischfield M A , Robson C D , Gilette N M , et al. Cerebral vein
malformations result from loss of Twist1 expression and BMP signa- ling from skull progenitor cells and dura [J] . Dev Cell , 2017 , 42 (5): 445 - 61 . e5 . doi : 10 . 1016/j . devcel. 2017 . 07 . 027 .
[5] Suh D C . Where did the dura mater come from? [J] . Neurointer- vention , 2020 , 15 (1 ): 2 - 3 . doi : 10 . 5469/neuroint. 2020 .
00045.
[6] Menon S , Salhotra A , Shailendra S , et al. Skeletal stem and pro-genitor cells maintain cranial suture patency and prevent craniosyn- ostosis [J] . Nat Commun , 2021 , 12(1): 4640 . doi : 10 . 1038/ s41467 - 021 - 24801 - 6 .
[7] Li B , Wang Y G , Fan Y , et al. Cranial suture mesenchymal stem cells : Insights and advances [ J] . Biomolecules , 2021 , 11(8): 1129 . doi : 10 . 3390/biom11081129 .
[8] Chagin A S , Trompet D . Dual stem-cell populations interact in the
skull [J] . Nature , 2023 , 621(7980): 698 - 9 . doi : 10 . 1038/ d41586 - 023 - 02547 - z .
[9] Dasgupta K , Jeong J. Developmental biology of the meninges [J] . Genesis , 2019 , 57(5): e23288 . doi : 10 . 1002/dvg. 23288 .
[10] Machida A , Okuhara S , Harada K , et al. Difference in apical and basal growth of the frontal bone primordium in Foxc1ch/ch mice [ J] . Congenit Anom (Kyoto), 2014 , 54(3): 172 - 7 . doi : 10. 1111 /cga. 12053 .
[11] Petrie C , Tholpady S , Ogle R , et al. Proliferative capacity and os- teogenic potential of novel dura mater stem cells on poly-lactic-co- glycolic acid [J] . J Biomed Mater Res A , 2008 , 85 (1): 61 - 71 . doi : 10 . 1002/jbm. a. 31367 .
[12] Peptan I A , Hong L , Evans C A . Multiple differentiation poten- tials of neonatal dura mater-derived cells [ J ] . Neurosurgery , 2007 , 60(2): 346 - 52 . doi : 10 . 1227/01 . NEU . 0000249278 . 72063. 59.
[13] Wang D , Gilbert J R , Zhang X , et al. Calvarial versus long bone : implications for tailoring skeletal tissue engineering [ J] . Tissue Eng Part B Rev , 2020 , 26 (1 ): 46 - 63 . doi : 10 . 1089/ten. TEB . 2018 . 0353 .
[14] Levine J P , Bradley J P , Roth D A , et al. Studies in cranial su- ture biology : regional dura mater determines overlying suture biolo- gy [J] . Plast Reconstr Surg , 1998 , 101(6): 1441 - 7 . doi : 10. 1097/00006534 - 199710000 - 00001 .
[15] Dong X H , Zhang M Z , Lai C Z , et al. Dura cells in the etio- pathogenesis of Crouzon syndrome : the effects of FGFR2 mutations in the dura cells on the proliferation of osteoblasts through the hip- po/YAP mediated transcriptional regulation pathway [ J] . Am J Transl Res , 2021 , 13(10): 11255 - 70 .
[16] Hobar P C , Schreiber J S , Mccarthy J G , et al. The role of the dura in cranial bone regeneration in the immature animal [ J ] . Plast Reconstr Surg , 1993 , 92 (3 ): 405 - 10 . doi : 10 . 1097/ 00006534 - 199309000 - 00003 .
[17] Gosain A K , Santoro T D , Song L S , et al. Osteogenesis in cal- varial defects : contribution of the dura , the pericranium , and the surrounding bone in adult versus infant animals [J] . Plast Recon- str Surg , 2003 , 112 (2 ): 515 - 27 . doi : 10 . 1097/01 . PRS . 0000070728. 56716. 51.
[18] White H E , Goswami A , Tucker A S . The intertwined evolution and development of sutures and cranial morphology [ J ] . Front Cell DevBiol , 2021 , 9 : 653579 . doi : 10 . 3389/fcell. 2021 . 653579.
[19] Liao J G , Huang Y P , Wang Q , et al. Gene regulatory network from cranial neural crest cells to osteoblast differentiation and cal- varial bone development [J] . Cell Mol Life Sci , 2022 , 79 (3 ): 158 . doi : 10 . 1007/s00018 - 022 - 04208 - 2 .
[20] Pierre L , Kondamudi N P. Subdural hematoma [M] . StatPearls : Treasure Island (FL) . 2022.
[21] Shafique S , Rayi A . Anatomy , head and neck , subarachnoidspace [M] . StatPearls:Treasure Island (FL) . 2022.
[22] Tanaka M . Embryological consideration of dural AVFs in relation to the neural crest and the mesoderm [ J ] . Neurointervention , 2019 , 14(1): 9 - 16 . doi : 10 . 5469/neuroint. 2018 . 01095 .
[23] Zhao X L , Erhardt S , Sung K , et al. FGF signaling in cranial su- ture development and related diseases [ J] . Front Cell Dev Biol , 2023 , 11 : 1112890 . doi : 10 . 3389/fcell. 2023 . 1112890 .
[24] Stanton E , Urata M , Chen J F , et al. The clinical manifestations , molecular mechanisms and treatment of craniosynostosis [ J] . Dis Model Mech , 2022 , 15 (4): dmm049390 . doi : 10 . 1242/dmm. 049390.
[25] Li B , Li J Y , Li B Z , et al. A single-cell transcriptomic atlas characterizes age-related changes of murine cranial stem cell niches [J] . Aging Cell , 2023 , 22(11): e13980 . doi : 10 . 1111 /acel. 13980.
[26] Ahmed E , Saleh T , Xu M F. Recellularization of native tissue de- rived acellular scaffolds with mesenchymal stem cells [ J] . Cells , 2021 , 10(7):1787 . doi : 10 . 3390/cells10071787 .
[27] Liu Y , Huang X , Yu H B , et al. HIF-1α-TWIST pathway re- strains cyclic mechanical stretch-induced osteogenic differentiation of bone marrow mesenchymal stem cells [J] . Connect Tissue Res , 2019 , 60 ( 6 ): 544 - 54 . doi : 10 . 1080/03008207 . 2019 . 1601185.
[28] Yu M F , Ma L , Yuan Y , et al. Cranial suture regeneration miti- gates skull and neurocognitivedefects in craniosynostosis [ J ] . Cell , 2021 , 184(1): 243 - 56 . e18 . doi : 10 . 1016/j . cell. 2020 . 11. 037.
[29] 寇正雄,张海燕,邵国,等. FAK/Twist1 信号通路在颅缝闭 合过程中的作用机制研究 [J] . 安徽医科大学学报,2023 , 58 (1): 60 - 6 . doi : 10 . 19405/j . cnki . issn1000 - 1492 . 2023 . 01 . 011.
[29] Kou Z X , Zhang H Y , Shao G , et al. The mechanism of FAK/Twist1 signal pathway in the closure of cranial suture [J] . Acta Univ Med Anhui , 2023 , 58(1): 60 - 6 . doi : 10 . 19405/j . cnki . issn1000 - 1492. 2023. 01. 011.
[30] Cooper G M , Durham E L , Cray J J , et al. Tissue interactions be- tween craniosynostotic dura mater and bone [ J ] . J Craniofac Surg , 2012 , 23 ( 3 ): 919 - 24 . doi : 10 . 1097/SCS . 0b013e31824e645f.
[31] Mehrara B J , Greenwald J , Chin GS , et al. Regional differentia- tion of rat cranial suture-derived dural cells is dependent on associ- ation with fusing and patent cranial sutures [ J] . Plast Reconstr Surg , 1999 , 104 (4 ): 1003 - 13 . doi : 10 . 1097/00006534 - 199909040 - 00016 .
[32] Warren S M , Greenwald J A , Nacamuli R P , et al. Regional dura mater differentially regulates osteoblast gene expression [ J ] . J Craniofac Surg , 2003 , 14 ( 3 ): 363 - 70 . doi : 10 . 1097/ 00001665 - 200305000 - 00015 .
[33] Galea G L , Zein M R , Allen S , et al. Making and shaping endo- chondral and intramembranous bones [ J] . Dev Dyn , 2021 , 250
(3): 414 - 49 . doi : 10 . 1002/dvdy. 278 .
[34] Beederman M , Farina E M , Reid R R. Molecular basis of cranial suture biology and disease : osteoblastic and osteoclastic perspec- tives [J] . Genes Dis , 2014 , 1(1): 120 - 5 . doi : 10 . 1016/j . gendis . 2014 . 07 . 004 .
[35] Twigg S RF , Wilkie AOW. Agenetic-pathophysiological frame-work for craniosynostosis [J] . Am J Hum Genet , 2015 , 97 (3): 359 - 77 . doi : 10 . 1016/j . ajhg. 2015 . 07 . 006 .
[36] Snider T N , Louie K W , Zuzo G , et al. Quantification of three-di- mensional morphology of craniofacial mineralized tissue defects in Tgfbr2/Osx-Cre mice [ J] . Oral Sci Int , 2021 , 18 (3 ): 193 - 202 . doi : 10 . 1002/osi2 . 1099 .
[37] Levi B , Wan D C , Wong V W , et al. Cranial suture biology : from pathways to patient care [J] . J Craniofac Surg , 2012 , 23(1): 13
- 9 . doi : 10 . 1097/SCS . 0b013e318240c6c0 .
[38] Gosain A K , Machol J A , Gliniak C , et al. TGF-beta1 RNA in- terference in mouse primary dura cell culture : downstream effects on TGF receptors , FGF-2 , and FGF-R1 mRNA levels [ J] . Plast Reconstr Surg , 2009 , 124(5): 1466 - 73 . doi : 10 . 1097/PRS . 0b013e3181b98947 .
[39] Li B , Li J Y , Fan Y , et al. Dissecting calvarial bones and sutures at single-cell resolution [J] . Biol Rev Camb Philos Soc , 2023 , 98
(5): 1749 - 67 . doi : 10 . 1111 /brv. 12975 .
[40] Yu H M I , Jerchow B , Sheu T J , et al. The role of Axin2 in cal- varial morphogenesis and craniosynostosis [ J ] . Development , 2005 , 132(8): 1995 - 2005 . doi : 10 . 1242/dev. 01786 .
[41] Furuhashi M , Yagi K , Yamamoto H , et al. Axin facilitates Smad3 activation in the transforming growth factor beta signaling pathway [J] . Mol Cell Biol , 2001 , 21(15): 5132 - 41 . doi : 10 . 1128/ MCB . 21 . 15 . 5132 - 5141 . 2001 .
[42] Behr B , Longaker M T , Quarto N . Absence of endochondral ossi- fication and craniosynostosis in posterior frontal cranial sutures of Axin2( - / - ) mice [ J] . PLoSOne , 2013 , 8 (8 ): e70240 . doi : 10 . 1371 /journal. pone . 0070240 .
[43] Jing D , Chen Z , Men Y , et al. Response of Gli1( + ) suture stem cells to mechanical force upon suture expansion [J] . J Bone Miner Res , 2022 , 37(7): 1307 - 20 . doi : 10 . 1002/jbmr. 4561 .
[44] Cleary M A , Narcisi R , Albiero A , et al. Dynamic regulation of TWIST1 expression during chondrogenic differentiationof human bone marrow-derived mesenchymal stem cells [ J ] . Stem Cells Dev , 2017 , 26(10): 751 - 61 . doi : 10 . 1089/scd . 2016 . 0308 .
[45] Marofi F , VAhedi G , Solali S , et al. Gene expression of TWIST1 and ZBTB16 is regulated by methylation modifications during the osteoblastic differentiation of mesenchymal stem cells [ J] . J Cell Physiol , 2019 , 234(5): 6230 - 43 . doi : 10 . 1002/jcp . 27352 .
[46] Camp E , Pribadi C , Anderson P J , et al. miRNA-376c-3p medi- ates TWIST-1 inhibition of bone marrow-derived stromal cell osteo- genesis and can reduce aberrant bone formation of TWIST-1 haplo- insufficient calvarial cells [J] . Stem Cells Dev , 2018 , 27 (23): 1621 - 33 . doi : 10 . 1089/scd . 2018 . 0083 .
[47] Lee K K L , Stanier P , Pauws E . Mouse models of syndromic cra- niosynostosis [J] . Mol Syndromol , 2019 , 10 (1 - 2): 58 - 73 . doi : 10 . 1159/000491004 .
[48] El Ghouzzi V , Le Merrer M , Perrin-Schmitt F , et al. Mutations of the TWIST gene in the Saethre-Chotzen syndrome [ J] . Nat Gen- et , 1997 , 15(1): 42 - 6 . doi : 10 . 1038/ng0197 - 42 .
[49] Goodnough L H , Dinuoscio G J , Atit R P. Twist1 contributes to
cranial bone initiation and dermal condensation by maintaining Wnt signaling responsiveness [J] . Dev Dyn , 2016 , 245(2): 144 - 56 . doi : 10 . 1002/dvdy. 24367 .
[50] Quarto N , Senarath-Yapa K , Renda A , et al. TWIST1 silencing enhances in vitro and in vivo osteogenic differentiation of human adipose-derived stem cells by triggering activation of BMP-ERK/ FGF signaling and TAZ upregulation [ J] . Stem Cells , 2015 , 33 (3): 833 - 47 . doi : 10 . 1002/stem. 1907 .
[51] Takebe H , Shalehin N , Hosoya A , et al. Sonic Hedgehog regu- lates bone fracture healing [ J] . Int J Mol Sci , 2020 , 21 (2): 677 . doi : 10 . 3390/ijms21020677 .
[52] Guo Y X , Yuan Y , Wu L , et al. BMP-IHH-mediated interplay between mesenchymal stem cells and osteoclasts supports calvarial bone homeostasis and repair [ J] . Bone Res , 2018 , 6 : 30 . doi : 10 . 1038/s41413 - 018 - 0031 - x.
[53] Lee S , Shen J , Pan H C , et al. Calvarial defect healing induced by small molecule smoothened agonist [ J] . Tissue Eng Part A , 2016 , 22(23 - 24): 1357 - 66 . doi : 10 . 1089/ten. TEA . 2016 . 0167.
[54] Chen G Q , Xu H D , Yao Y F , et al. BMP signaling in the devel- opment and regeneration of cranium bones and maintenance of cal- varial stem cells [ J] . Front Cell Dev Biol , 2020 , 8 : 135 . doi : 10 . 3389/fcell. 2020 . 00135 .
[55] Hokugo A , Sorice S , Yalom A , et al. In vitro study of a novel ox- ysterol for osteogenic differentiation on rabbit bone marrowstromal cells [J] . Plast Reconstr Surg , 2013 , 132(1): 70e - 80e . doi : 10 . 1097/PRS . 0b013e318290f460 .
[56] Roth D M , Souter K , Graf D . Craniofacial sutures : signaling cen- tres integrating mechanosensation , cell signaling , and cell differ- entiation [J] . Eur J Cell Biol , 2022 , 101 (3 ): 151258 . doi : 10 . 1016/j . ejcb . 2022 . 151258 .
[57] Zhao F N , Zhu J L , Dong X H , et al. The influence of extracellu- lar vesicles secreted by dural cells on osteoblasts [ J] . Mol Bio- technol , 2023 , doi : 10 . 1007/s12033 - 023 - 00974 - x.
[58] Slater B J , Kwan M D , Gupta D M , et al. Dissecting the influ- ence of regional dura mater on cranial suture biology [ J] . Plast Reconstr Surg , 2008 , 122 (1 ): 77 - 84 . doi : 10 . 1097/PRS . 0b013e318177478c .
[59] Yamanaka S . Pluripotent stem cell-based cell therapy-promise and challenges [J] . Cell Stem Cell , 2020 , 27 (4 ): 523 - 31 . doi : 10 . 1016/j . stem. 2020 . 09 . 014 .
[60] Maruyama T , Stevens R , Boka A , et al. BMPR1A maintains skel- etal stem cell properties in craniofacial development and craniosyn- ostosis [ J] . Sci Transl Med , 2021 , 13 (583 ): eabb4416 . doi : 10 . 1126/scitranslmed . abb4416 .
文章来源:安徽医科大学学报 2024 Sep;59(9)
注:转载内容,如有侵权,请联系删除